基礎醫學院張宏權等非組蛋白新修飾研究成果在Cell Research發表
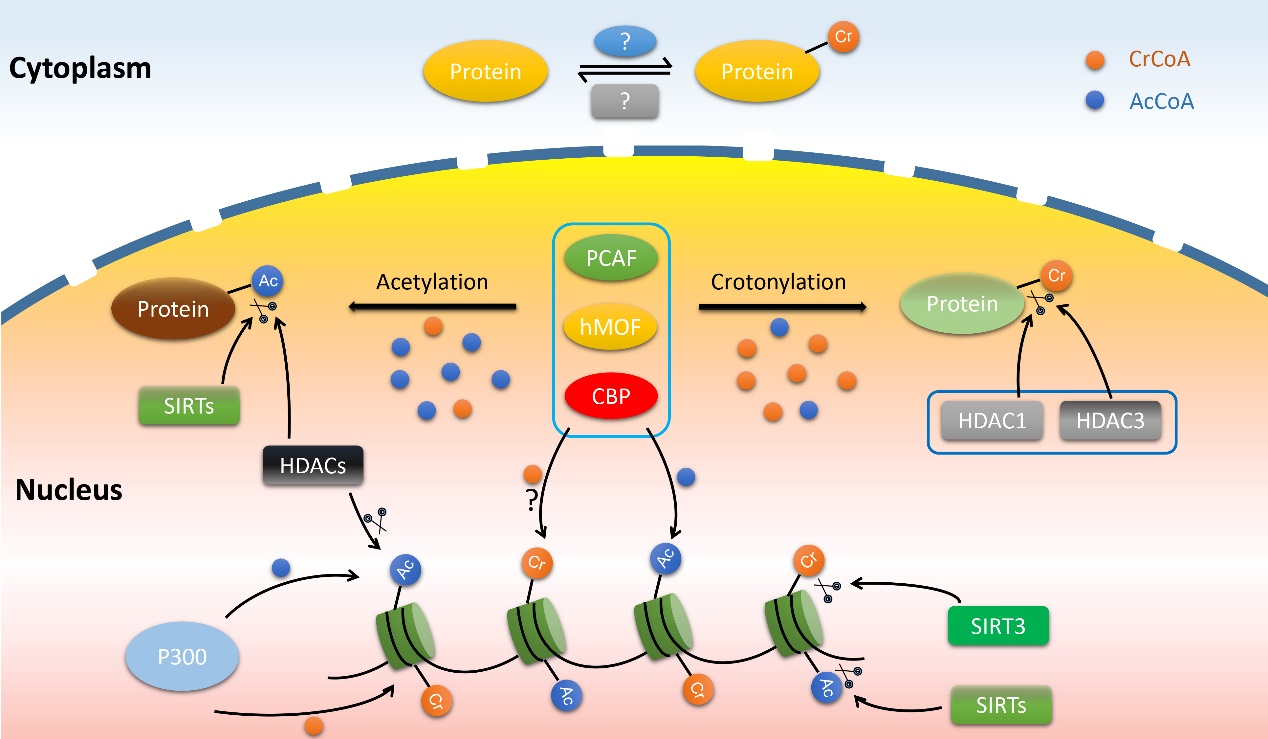
Newly identified crotonyltransferases and decrotonylases for non-histone proteins. Boxed are new findings.
2017年4月21日💁🏼♂️,意昂2平台基礎醫學院人體解剖與組織胚胎學系張宏權教授團隊在國際著名學術期刊Cell Research在線發表題為“Global profiling of crotonylation on non-histone proteins”的論文🦶🏻。論文通訊作者為張宏權教授,其博士研究生許煒智、萬軍虎為共同第一作者🤲🏽。該研究得到杭州景傑蛋白質翻譯後修飾有限責任公司科學家的協助🏃🏻♀️➡️🥏。
該研究首次發現了能夠催化非組蛋白巴豆酰化和去巴豆酰化這兩個相反過程的酶🦴:乙酰轉移酶CBP、PCAF、hMOF也能夠催化非組蛋白的巴豆酰化📰,而去乙酰化酶HDAC1和HDAC3也能夠發揮去巴豆酰化的作用🏊🏻♀️。這一重要發現為非組蛋白巴豆酰化修飾的深入研究奠定了堅實的基礎,同時開拓了新的研究領域💆🏽🚴🏿:蛋白質的巴豆酰化修飾可能比乙酰化修飾在腫瘤發生發展進程中發揮更為重要的作用。
巴豆酰化(Crotonylation)是新近發現的一種存在於組蛋白賴氨酸上的酰基化修飾,組蛋白的巴豆酰化修飾相較於組蛋白的乙酰化具有更強的轉錄激活功能。目前僅有乙酰轉移酶P300能夠催化組蛋白的巴豆酰化的報道,而且也只知道去乙酰化酶SIRT3能介導組蛋白的去巴豆酰化💂🏽♀️。
該課題組一直關註腫瘤轉移重要調節蛋白的翻譯後修飾及其相關功能和機製✔️,並於2015年和2016年在國際權威雜誌Nucleic Acids Research上分別發表了作為非組蛋白(Non-histone proteins)的甲基轉移酶EZH2以及轉錄因子HOXB9存在乙酰化修飾的研究論文,揭示出二者的乙酰化在腫瘤發生發展及鑒別診斷中起重要作用⛷。為了探究非組蛋白是否也存在巴豆酰化修飾,課題組選擇了人肺腺癌細胞系H1299通過蛋白質組學分析方法𓀖,在全蛋白質組範圍內發現1024個存在巴豆酰化修飾的蛋白質以及2696個被巴豆酰化修飾的位點🧏♂️🤷🏻,並隨機挑選12個蛋白分子進行細胞內源性巴豆酰化修飾的驗證🧊。以蛋白NPM1和DDX5作為底物,發現了乙酰轉移酶CBP、PCAF🍰𓀗、hMOF能夠催化非組蛋白的巴豆酰化,而去乙酰化酶HDAC1和HDAC3具有去巴豆酰化的功能。這些結果表明乙酰化和巴豆酰化對於細胞核內的非組蛋白可共用同一套酰基轉移酶及去酰基酶💫。同時✣,課題組還提出了巴豆酰化和乙酰化可同時發生在一個底物上的假設🏌🏻:一個底物的兩種酰基化程度取決於細胞內巴豆酰輔酶A(CrCoA)以及乙酰輔酶A(AcCoA)相對濃度;同時,酰基化的程度也決定了去乙酰化以及去巴豆酰化的發生與否。因此📛,共用同一套修飾酶能讓這一系列酶反應過程更快速地進行,在一定程度上簡化和加快了底物的修飾過程,以適應細胞內復雜的生物學功能需要🟠。
該工作得到了國家自然科學基金重點和面上項目👩🏽💻、國家科技部“973計劃”項目及北京市自然科學基金重大項目的資助。
論文鏈接:http://www.nature.com/cr/journal/vaop/ncurrent/full/cr201760a.html
(基礎醫學院)
編輯👱🏽:韓娜


